2021年2月9号,国际着名学术期刊Oncogene在线发表了时玉舫教授团队的最新研究成果“HDAC inhibition potentiates anti-tumor activity of macrophages and enhances anti-PD-L1-mediated tumor suppression”。 在该项研究中,研究人员发现低剂量的组蛋白去乙酰化酶抑制剂(histone deacetylases inhibitor,HDACi) 曲古霉素A(TSA)通过重编程肿瘤浸润性巨噬细胞的功能,参与重塑肿瘤免疫微环境,进而提高了T细胞的肿瘤浸润和抑瘤功能。该研究为抗肿瘤免疫治疗找到新的策略。
该团队早期发现HDACi能够阻断激活诱导的T细胞死亡(AICD)并增强抗肿瘤免疫(Oncogene 34, 5960–5970,2015)。全面认识HDACi调控肿瘤微环境中免疫细胞的功能对于指导临床免疫治疗具有重要意义。该研究运用免疫功能正常的小鼠模型同时研究了HDACi对先天免疫与获得性免疫的效应,发现低剂量HDACi能够激起强大的局部免疫和系统性抗肿瘤反应。HDACi对巨噬细胞具有重编程作用,使巨噬细胞向促炎抗肿瘤的M1型转变,从而改善肿瘤微环境,提高肿瘤内淋巴细胞的浸润及细胞因子的分泌能力。清除体内巨噬细胞实验进一步证明,HDACi的抗肿瘤效应依赖于巨噬细胞的存在。然而,HDACi也具有上调肿瘤细胞PD-L1表达的作用,因此限制了HDACi的抗肿瘤活性。据此,研究人员选用低剂量HDACi与免疫检查点抑制剂PD-L1抗体联合治疗,结果表明,两者能够发挥协同抗肿瘤作用,有效减缓肿瘤生长和肿瘤肺转移能力,提高荷瘤小鼠的生存率。肿瘤微环境分析提示,联合治疗不仅可以减少M2巨噬细胞,还可以增加M1抗肿瘤巨噬细胞的比例,也能显着增加CD4+和CD8+ T细胞的浸润和IFN-γ、TNF-α细胞因子的分泌能力。
综上所述,该研究阐明了低剂量HDACi重编程肿瘤相关巨噬细胞,使其具有抗肿瘤活性,从而改善肿瘤微环境发挥抗肿瘤作用;并且联合PD-L1抗体具有增强抗肿瘤效应,为肿瘤免疫治疗提供新的策略。
该论文的第一作者是博士生李小雷,时玉舫教授和邵常顺教授为论文的共同通讯作者。经费支持来自于国家科技部重点研发计划、国家自然科学基金委、江苏省社会发展项目和国重实验室等。
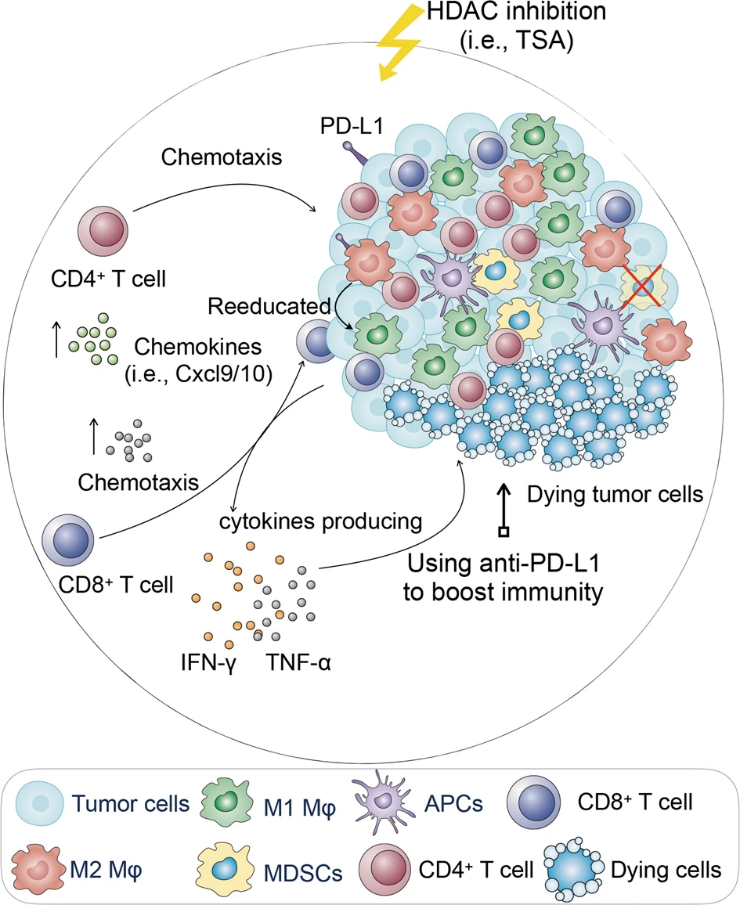
图注:HDACi将肿瘤内的巨噬细胞转化为促炎性巨噬细胞,同时抑制MDSC向肿瘤浸润,促进T细胞反应以抑制肿瘤生长;HDACi还可与免疫检查点的疗法协同发挥抗肿瘤免疫反应。
文章链接:https://www.nature.com/articles/s41388-020-01636-x正规beat365旧版_365bet开户网站_best365网页版登录
